Souhrn
Somatické kolifágy jsou novým ukazatelem kontroly účinnosti úpravy a čištění vody zmiňovaným ve směrnici Evropského parlamentu a Rady (EU) 2020/2184 ze dne 16. prosince 2020 o jakosti vody určené k lidské spotřebě a i v nařízení Evropského parlamentu a Rady (EU) 2020/741 ze dne 25. května 2020 o minimálních požadavcích na opětovné využívání vody. Z tohoto důvodu bude nezbytné v blízké době postupně zavádět metodu stanovení somatických kolifágů ve vodách do některých provozních či jiných laboratoří. Možnost využití kultivačního postupu v souladu s postupem v normě ČSN EN ISO 10705-2 [3] je řešena od roku 2019 v mikrobiologické laboratoři Ústavu technologie vody a prostředí na VŠCHT Praha. Somatické kolifágy byly zjišťovány ve vzorcích různě zatížených vod, resp. v povrchových vodách, odpadních vodách (odtoky z čistíren odpadních vod) a šedých vodách. Experimentálně byly také zkoušeny a ověřovány vybrané koncentrační metody (flokulace hydroxidem hořečnatým a membránová filtrace), které je nutné používat pro vzorky vod s nízkým výskytem somatických kolifágů (< 3 PTJ/ml). Na základě provedených testů bylo zjištěno, že metoda membránové filtrace s využitím elektronegativních filtrů vykazuje vyšší účinnost při zkoncentrování somatických kolifágů ze vzorku vody než flokulace hydroxidem hořečnatým.
Úvod
Z vodárenské praxe jsou za posledních několik let známy případy kontaminace pitné vody virovým agens, ať už se jednalo o případy spojené s výskytem enterovirů, norovirů, nebo adenovirů. Tyto případy byly tiskem a odbornou veřejností medializované. Viry jsou všeobecně považovány za více rezistentní živé systémy (organismy) vůči biologickým i fyzikálně-chemickým vlivům prostředí než bakterie. I přes rizikovost tohoto mikroorganismu není požadavek na jeho stanovení v rámci prováděných mikrobiologických analýz vody zohledněn např. vyhláškou č. 252/2004 Sb., v platném znění, kterou se stanoví hygienické požadavky na pitnou a teplou vodu a četnost a rozsah kontroly pitné vody. Většinu virů není možné kultivačním postupem detekovat, namísto nich se uplatňují metody molekulární biologie (např. PCR = polymerázová řetězová reakce), které vyžadují adekvátní vybavení laboratoře, což je patřičně i ekonomicky nákladné. Stanovení některých typů virů kultivačně je na provedení v provozní mikrobiologické laboratoři náročné, protože jsou zapotřebí přítomné hostitelské buňky vybraných kmenů bakterií a optimalizované postupy.
Somatické kolifágy jsou v současné době velmi diskutovaným tématem v oblasti kontroly kvality vody, protože vykazují určitou morfologickou podobnost jako lidské enterické viry a je možné na ně pohlížet jako na případné indikátorové organismy přítomnosti virové kontaminace ve vodách. Kvůli stále se zvyšujícím požadavkům na kvalitu pitné vody i tlakům společnosti na opětovné využívání vyčištěných odpadních vod, byly somatické kolifágy legislativně navrženy jako nové ukazatele pro kontrolu účinnosti úpravy a čištění vody. Z toho důvodu je velice žádoucí kontrola jejich přítomnosti v některých typech vod, zejména ke kontrole vody určené pro lidskou spotřebu. Somatické kolifágy jsou skupinou nepatogenních bakteriálních virů tzv. „bakteriofágů“, které infikují buňky koliformních bakterií (skupina Enterobacteriaceae), a zejm. pak buňky bakterie druhu Escherichia coli. Přirozeným prostředím somatických kolifágů je, stejně jako pro bakterie Escherichia coli, gastrointestinální trakt člověka a teplokrevných organismů.
Dne 12. 1. 2021 vstoupila v platnost směrnice Evropského parlamentu a Rady (EU) 2020/2184 ze dne 16. 12. 2020 o jakosti vody určené k lidské spotřebě, která je kompletně přepracovanou novelou stávající směrnice č. 98/83/EC. Předpoklad implementace této směrnice do národních právních předpisů je konec roku 2022 až začátek roku 2023.
Účelem směrnice pro pitnou vodu je ochrana zdraví spotřebitelů před následky užívání znečištěné vody a zajištění zdravotní nezávadnosti pitné vody prostřednictvím definovaných norem kvality, které jsou členské státy EU povinné dodržovat. Revize se mimo jiné věnovala právě aktualizaci seznamu ukazatelů kvality pitné vody, které již neodpovídaly současným poznatkům. Somatické kolifágy jsou novým ukazatelem, který bude muset být sledován v rámci provozního monitorování účinnosti procesu úpravy pitné vody, pokud ve zdroji surové vody bude zjištěno > 50 PTJ/100 ml (PTJ = plak tvořící jednotku) [1].
Somatické kolifágy jsou rovněž zmiňovány v novém nařízení Evropského parlamentu a Rady (EU) 2020/741 ze dne 25. května 2020 o minimálních požadavcích na opětovné využívání vody [2]. Díky tomuto nařízení by mělo být pro členské státy Evropské unie (EU) snadnější opětovně využívat vyčištěné městské odpadní vody, a to zejména k závlahám v zemědělství. Kromě minimálních požadavků na kvalitu recyklované vody, stanovuje nařízení také četnost rutinního a validačního monitorování. Somatické kolifágy je nutné posuzovat v rámci validačního monitorování zařízení u kategorie s nejpřísnějšími požadavky na kvalitu vody (třída A, pro kterou platí: „Všechny potravinářské plodiny konzumované za syrova, jejichž jedlá část je v přímém kontaktu s recyklovanou odpadní vodou, a kořenové plodiny konzumované za syrova.“) [2]. Smyslem validačního monitorování je hodnocení účinnosti daného zařízení v odstranění vybraných indikátorových organismů patogenních bakterií, prvoků a virů.
Po vyhlášení přijatých legislativních dokumentů v Úředním věstníku EU mají následně členské státy EU povinnost zapracovat příslušné změny do svých právních předpisů. Nařízení EU je možné přímo aplikovat v členských státech EU. Metodu stanovení somatických kolifágů ve vodách bude tedy nezbytné zavést do některých provozních či jiných laboratoří, a tyto laboratoře budou muset následně věnovat určitý čas optimalizaci metody.
Možnost využití kultivačního postupu v souladu s postupem v normě ČSN EN ISO 10705-2 [3] je soustavně řešena od roku 2019 v mikrobiologické laboratoři Ústavu technologie vody a prostředí na VŠCHT Praha. Metoda uvedená touto normou se používá pro detekci somatických kolifágů v různě zatížených vodách. Při zkoušení postupu stanovení podle uvedené normy se zjišťovaly možnosti a případná uplatnění metody specifikované normou [3] pro běžný mikrobiologický monitoring stavu mikrobiální kontaminace (resp. fekálního znečištění) povrchových vod, odpadních vod (odtoky z čistíren odpadních vod) a šedých vod. Pro zajímavost byla do testů zařazena i pitná voda. Experimentálně byly zkoušeny a ověřovány koncentrační metody, které je nezbytné používat pro vzorky vod s nízkým výskytem somatických kolifágů (< 3 PTJ/ml) a jsou uvedené v normě ČSN ISO 10705-3 [4] (platné od 1. 12. 2020). Postupy stanovení a problémy spojené s metodami uvedenými v normě ČSN EN ISO 10705-2 [3] a v normě pro koncentrační metody ČSN ISO 10705-3 [4] jsou diskutovány dále v příspěvku.
Metodika
Za účelem stanovení somatických kolifágů byly odebírány vzorky povrchových vod, odtoků z ČOV, šedých vod a pitné vody. Somatické kolifágy byly následně stanovovány podle postupu uvedeného v normě ČSN EN ISO 10705-2 [3], Část 2: Kvantitativní stanovení somatických kolifágů. Vzhledem k tomu, že zmíněná metoda je vhodná spíše pro vody s vyšším výskytem somatických kolifágů, byly experimentálně ověřovány vybrané koncentrační metody navrhované v příloze A normy ČSN ISO 10705-3 [4], Část 2: Validace metod pro zkoncentrování bakteriofágů z vody (metoda membránové filtrace a flokulace hydroxidem hořečnatým).
Postup stanovení somatických kolifágů
Metoda stanovení podle ČSN EN ISO 10705-2 [3] spočívá v kultivaci a udržování příslušného hostitelského kmene Escherichia coli, který je následně použit pro stanovení somatických kolifágů pomocí dvouvrstvé plakové titrace. Pro účely testování byl hostitelský kmen Escherichia coli získán ze sbírky Státního zdravotního ústavu v Praze, kde je veden pod označením CNCTC 5005. Z obdrženého lyofilizovaného referenčního hostitelského kmene byla postupně pomocí modifikovaného Scholtensova média (MSB) připravena štoková a pracovní kultura. Požadovaná hustota (108 KTJ/ml) buněk pracovní kultury byla před stanovením somatických kolifágů kontrolována spektrofotometricky pomocí měření absorbance, a to na základě předem provedené kalibrace mezi absorbancí a počtem kolonií narostlých na modifikovaném Scholtensovu médiu MSA.
Samotné stanovení somatických kolifágů bylo následně prováděno podle standardního postupu uvedeného v normě [3] s drobnými modifikacemi. K temperování roztopeného polotekutého Scholtensova média (ssMSA) s přídavkem chloridu vápenatého byla použita vodní lázeň o teplotě 45 °C. Do sterilních bakteriologických zkumavek umístěných ve vodní lázni bylo postupně pipetováno 2,5 ml ssMSA média, 1 ml inokulační kultury hostitelského kmene E. coli a 1 ml analyzovaného vzorku. Směs byla promíchána a následně byla nalita na povrch kompletního média MSA v Petriho misce. Po zatuhnutí byly misky inkubovány v závěsné poloze při teplotě 37 °C po dobu cca 18 h. Somatické kolifágy tvoří na povrchu média viditelné zóny projasnění, tzv. plaky, které se odečítají a následně vyjadřují jako počet plaků tvořících jednotky (PTJ) v objemové jednotce. Pro kontrolu správnosti provedení bylo zároveň prováděno slepé stanovení, kterým je směs inokulační kultury hostitelského kmene a polotekutého ssMSA média.
Koncetrační metody
Účinnosti vybraných koncentračních metod, v tomto případě membránové filtrace a flokulace hydroxidem hořečnatým, byly experimentálně zkoušeny na reálných vzorcích odpadních vod odebíraných na odtoku z městské mechanicko-biologické čistírny odpadních vod (ČOV). Obě metody byly testovány metodou standardního přídavku. Pro zjištění účinnosti flokulace bylo dávkováno 10 ml vzorku odtoku z ČOV do 90 ml odstáté kohoutkové vody. V případě testování membránové filtrace byl do 100 ml (případně 90 ml) destilované vody pipetován 1 ml (případně 10 ml) vzorku odtoku z ČOV. Ve vzorku odtoku z ČOV, tzn. ve vzorku pro přídavek, byly paralelně stanovovány somatické kolifágy podle normy ČSN EN ISO 10705-2 [3]. Takto připravené suspenze byly následně předupraveny jednotlivými koncentračními metodami pro zachycení kolifágů.
Metoda flokulace hydroxidem hořečnatým spočívá v separaci kolifágů zachycených do vznikajících vloček. K testovanému objemu připraveného vzorku jsou postupně přidávány roztoky chloridu hořečnatého (1 mol/l) a hydrogenfosforečnanu draselného (1 mol/l), a to v objemu uvedeném v normě ČSN ISO 10705-3 [4]. Po kapkách se přidává roztok hydroxidu sodného (2 mol/l) do vzniku viditelného zákalu, přičemž je současně kontrolována hodnota pH, která by neměla přesahovat hodnotu 8,6. Suspenze se pomalu míchá po dobu cca 15 minut, přičemž vznikající vločky následně sedimentují cca 30 minut. Po opatrném odtažení supernatantu je řídký sediment zkoncentrován pomocí centrifugace při malé rychlosti (relativní centrifugační zrychlení RCF = 1 000 g) po dobu 15 minut. Po slití supernatantu je sediment resuspendován pomocí peptonové vody s chloridem sodným a intenzivním třepáním. Stanovení somatických kolifágů následně probíhá podle normy ČSN EN ISO 10705-2 [3]. V rámci testování účinnosti koncentrační metody byl rovněž sledován vliv hodnoty pH při flokulaci (hodnoty pH: 7,6; 8,0; 8,3; 8,6 a 9,0).
Metoda membránové filtrace spočívá ve filtraci daného objemu vzorku přes elektronegativní filtr ze směsi acetátu celulózy a nitrátu celulózy, o velikosti pórů 0,22 μm a průměru 47 mm. Filtraci předchází přídavek roztoku chloridu hořečnatého. Filtr je následně rozstříhán na cca 8 menších částí a vložen do skleněné baňky s elučním roztokem (1 % hovězí extrakt, 0,5 mol/l NaCl, 3 % Tween 80), který se vloží do ultrazvukové lázně na cca 4 minuty. Stanovují se současně somatické kolifágy uvolněné do elučního roztoku a zachycené na filtrech. V rámci testování účinnosti metody byl sledován také vliv složení elučního roztoku (zde: 1 % hovězí extrakt, 0,5 mol/l NaCl; 1 % hovězí extrakt, 0,5 mol/l NaCl, 3 % Tween 80; 3 % hovězí extrakt, 0,5 mol/l NaCl; 3 % hovězí extrakt, 0,5 mol/l NaCl, 3 % Tween 80).
Výsledky a diskuse
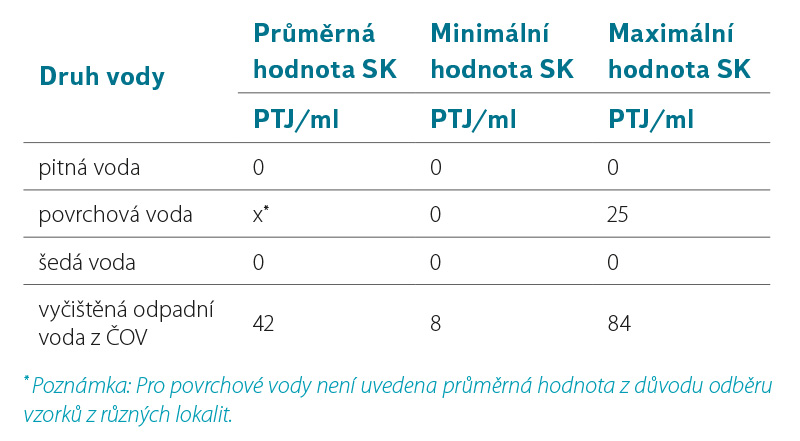
Výskyt somatických kolifágů ve vodním prostředí obvykle indikuje znečištění způsobené zvířecími nebo lidskými fekáliemi. Přestože jsou přirozenými hostitelskými kmeny somatických kolifágů bakterie druhu Escherichia coli, bylo některými studiemi zjištěno, že pro svou replikaci mohou využívat i jiné příbuzné bakteriální druhy, které nejsou fekálního původu [5]. Porovnání výskytu somatických kolifágů v různě zatížených vodách, resp. v pitných vodách, povrchových vodách, šedých vodách a ve vyčištěných odpadních vodách (odtok z ČOV) je patrné v tabulce 1. Stanovení bylo provedeno podle postupu uvedeného v normě ČSN EN ISO 10705-2 [3]. V testovaných povrchových vodách se počty somatických kolifágů pohybovaly v rozmezí od 0 do 25 PTJ/ml. Vzhledem k tomu, že byly odebírány a analyzovány různé typy povrchových vod (tekoucí, stojaté) z odlišných lokalit, není uváděna průměrná hodnota počtu PTJ. Z testovaných vod byly nejvyšší počty somatických kolifágů nacházeny v odtocích z čistíren odpadních vod. Celkem bylo otestováno šest různých ČOV, přičemž nálezy somatických kolifágů se v odtocích pohybovaly v rozmezí od 8 do 84 PTJ/ml s průměrnou hodnotou cca 42 PTJ/ml. V odpadních vodách na přítoku ČOV nebyly laboratorně somatické kolifágy zatím zjišťovány (důvodem je zvýšený výskyt doprovodné mikroflóry, která ruší odečet plaků při vyhodnocování). Pro doplnění, odborná literatura uvádí počty somatických kolifágů na přítocích do ČOV v rozsahu od 5·106 do 5·107 PTJ/100 ml [6]. U vzorků šedých vod, ve kterých je výskyt koliformních bakterií a případně E. coli obvyklý a byl v analyzovaných vzorcích potvrzen (viz tabulka 1), nebyla přítomnost somatických kolifágů kultivačně potvrzena. V pitných vodách odebíraných z kohoutku u spotřebitele nebyla podle očekávání přítomnost somatických kolifágů zjištěna.
Tabulka 1. Výskyt somatických kolifágů v různých druzích vod – postup podle normy ČSN EN ISO 10705-2 [3]
Table 1. Occurrence of somatic coliphages in various types of waters – procedure according to the standard ČSN EN ISO 10705-2 [3]
Vzhledem k tomu, že stanovení somatických kolifágů podle normy ČSN EN ISO 10705-2 [3] využívá standardně k analýze 1 ml vzorku, může tento postup vést k chybě a nesprávné interpretaci výsledků zkoušky při analýze vod s nižší koncentrací kolifágů a nižším mikrobiálním znečištěním. Vody méně mikrobiálně oživené, např. povrchové stojaté a tekoucí vody, šedé vody a pitné vody vyžadují předúpravu vzorku metodou jejich zkoncentrování podle ČSN ISO 10705-3 [4]. Použití spolehlivé metody zkoncentrování somatických kolifágů ve vzorku vody před jeho analýzou může účinnost detekce výrazně zlepšit. V grafech na obr. 1–3 jsou uvedeny laboratorně zjištěné účinnosti koncentračních metod flokulace hydroxidem hořečnatým a membránové filtrace. U metody flokulace hydroxidem hořečnatým se účinnost zkoncentrování somatických kolifágů pohybovala v rozmezí od cca 32 do 64 %, přičemž byla zjištěna její závislost na hodnotě pH. Nejvyšší počty somatických kolifágů byly stanoveny u vzorků s pH 8,0 (účinnost zkoncentrování cca 64 %) a 8,3 (účinnost zkoncentrování cca 64 %), viz obr. 1. Lze předpokládat, že účinnost záchytu kolifágů do vloček bude vyšší u koncentrování více organicky zatížené vody. Výrazně vyšší účinnost vykazovala oproti flokulaci metoda membránové filtrace. V závislosti na použitém elučním roztoku se účinnost pohybovala v rozmezí cca 40 až 100 %, viz obr. 2. Zásadní je pro uvolnění somatických kolifágů z membránových filtrů obsah neiontového tenzidu Tween 80 v elučním roztoku. S jeho pomocí bylo ve většině případů dosahováno cca 100 % účinnosti zkoncentrování somatických kolifágů. Jak je patrné z obr. 3, má v postupu koncentrování membránovou filtrací důležitý význam také chlorid hořečnatý, který je ke vzorku přidáván před jeho zfiltrováním. Bez jeho použití se průměrné účinnosti záchytu somatických kolifágů v závislosti na elučním roztoku pohybovaly v rozmezí 19–52 %. Multivalentní kationty, jako je Mg2+, Ca2+ a Al3+, umožňují při nižším pH účinnější adsorpci kolifágů na elektronegativních membránových filtrech [7].
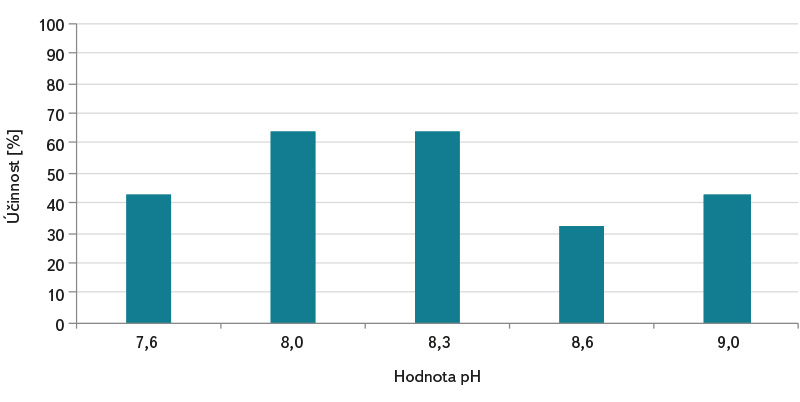
Obr. 1. Účinnost flokulace hydroxidem hořečnatým při zkoncentrování somatických kolifágů a vliv hodnoty pH
Fig. 1. Magnesium hydroxide flocculation efficiency in the concentration of somatic coliphages and the effect of pH
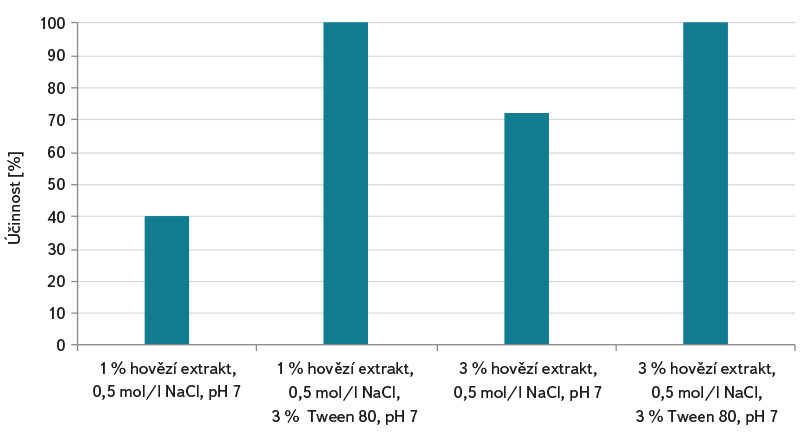
Obr. 2. Účinnost membránové filtrace podle postupu v ČSN ISO 10705-3 [4] (včetně přídavku MgCl2) při zkoncentrování somatických kolifágů a vliv různého elučního roztoku
Fig. 2. Membrane filtration efficiency according to the procedure in ČSN ISO 10705-3 [4] (including the addition of MgCl2) in the concentration of somatic coliphages and the effect of different elution solution
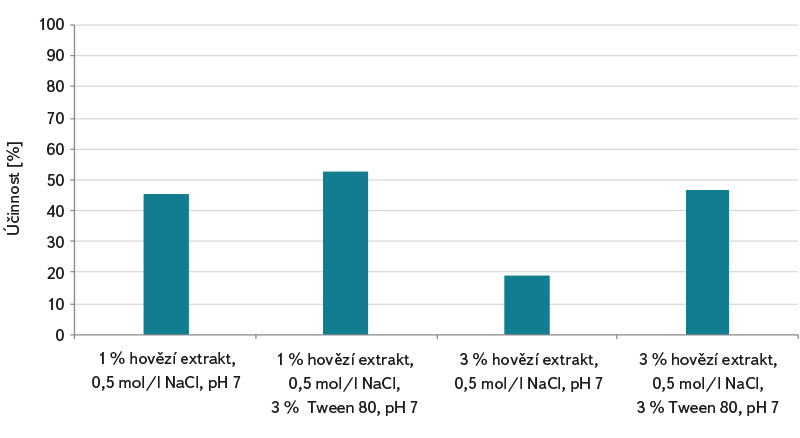
Obr. 3. Účinnost membránové filtrace podle postupu v ČSN ISO 10705-3 [4] (bez přídavku MgCl2) při zkoncentrování somatických kolifágů a vliv různého elučního roztoku
Fig. 3. Membrane filtration efficiency according to the procedure in ČSN ISO 10705-3 [4] (without addition of MgCl2) in the concentration of somatic coliphages and the effect of different elution solution
Problémy řešené při stanovení somatických kolifágů ve vodách
Stanovení somatických kolifágů bylo v tomto prezentovaném případě, až na několik drobných modifikací, provedeno podle platné normy ČSN EN ISO 10705-2 [3]. Mezi tyto drobné modifikace lze uvést například pořadí aplikace jednotlivých složek do bakteriologických zkumavek. Zpočátku byla zejména kvůli rychlému tuhnutí (tvorbě hrudek) polotekutého média ssMSA dávána přednost prvotní aplikaci 1 ml testovaného vzorku, 1 ml inokulační kultury a až následně přídavku 2,5 ml média ssMSA. Nicméně, pomocí prováděných kontrolních slepých stanovení bylo zjištěno, že prvotní aplikací vzorku do bakteriologických zkumavek může následně docházet ke křížové kontaminaci inokulační kultury a ssMSA média kolifágy. Preferována byla tedy aplikace v následujícím pořadí: polotekuté médium ssMSA, inokulační kultura, testovaný vzorek. Řešením rychlého tuhnutí polotekutého ssMSA média může být buď přídavek nižší navážky agaru s rizikem sesunutí vrchní vrstvy, nebo volba agaru o nižší teplotě tuhnutí. Případně je možné testovaný vzorek aplikovat do bakteriologických zkumavek takovým způsobem, aby pomalu stékal po vytemperované stěně zkumavky. Připravená směs byla vždy zlehka ručně promíchána kvůli zamezení vzniku vzduchových bublin a rychle nalita na kompletní médium MSA v Petriho miskách. Vyhodnocení, resp. odečet vzniklých plaků somatických kolifágů ruší nejen přítomnost vzduchových bublin, ale také přítomnost kondenzované vody ulpěné na povrchu zatuhlé horní vrstvy (i v závěsné poloze). Z toho důvodu by měly být misky před inkubací nejprve předsušeny s částečně otevřenými víčky v termostatu (toto uvádí norma ČSN EN ISO 10705-2 [3] a je to důležité).
Při experimentálním ověření vybraných koncentračních metod popsaných v normě ČSN ISO 10705-3 [4] byly rovněž nalezeny některé problémové postupy. V případě metody flokulace hydroxidem hořečnatým viditelně nedocházelo k sedimentaci všech vzniklých vloček. Z důvodu jejich co největšího záchytu bylo nutné odstřeďovat větší objem vzorku, resp. bylo využíváno zkumavek o objemu 50 ml. Resuspendování vzniklého sedimentu v peptonové vodě s obsahem NaCl může být v menším objemu než 30 ml problémové, vločky v některých případech nebylo možné rozpustit ani intenzivním třepáním ani vortexováním (promíchání vírem kapaliny). V případě vzorku o nízké koncentraci kolifágů (< 3 PTJ/ml), který je koncentrován flokulací, by bylo vhodné pracovat zároveň s jeho dvěma různými objemy, z nichž alespoň jeden umožní kvantifikaci plaků v 1 ml (příp. 5 ml) zřeďovacího roztoku o celkovém objemu 30 ml.
Oproti flokulaci je metoda membránové filtrace podstatně rychlejší a jednodušší. Nejvíce problémová je v tomto případě práce s filtry. Po provedené filtraci vzorku by měly být jednotlivé filtry rozstříhány na cca osm částí, upraveny v ultrazvukové lázni a následně aplikovány lícem dolů na vrstvu média ssMSA s hostitelským kmenem. Zároveň s filtry by měl být stanoven eluční roztok metodou podle ČSN EN ISO 10705-2 [3]. Nejenže tato práce s filtry vyžaduje určitou zručnost s pinzetou, ale nepřináší ani očekávané výsledky, resp. somatické kolifágy v podobě plaků není možné z kultivovaných ploten s jistotou odečíst, viz obr. 4.
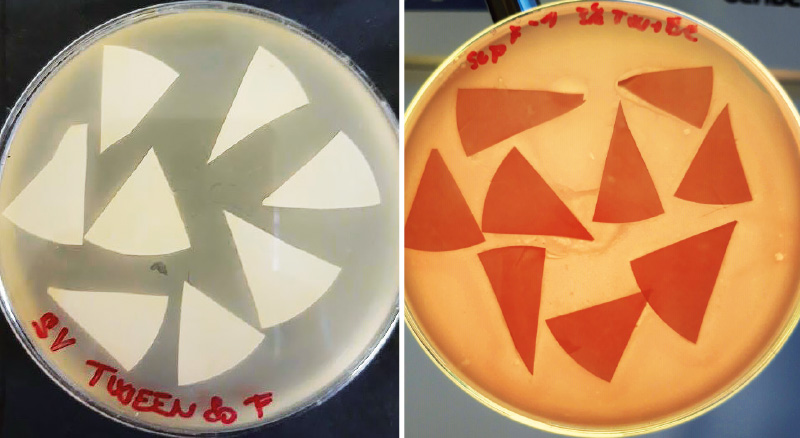
Obr. 4. Stanovení somatických kolifágů pomocí membránové filtrace – problematický odečet zachycených kolifágů na filtrech
Fig. 4. Determination of somatic coliphages using membrane filtration – problematic enumeration of captured coliphages on filters
Závěr
Indikace fekálního znečištění je důležitým nástrojem pro zjištění zdravotní nezávadnosti vody. V poslední době se pozornost přesouvá na další možné indikátorové organismy, resp. na somatické kolifágy, které mohou být využity při sledování účinnosti odstranění malých a více rezistentních částic (např. viry) procesem úpravy vody nebo čištění vod. V rámci testů provedených v mikrobiologické laboratoři Ústavu technologie vody a prostředí na VŠCHT Praha bylo zjištěno, že postup stanovení somatických kolifágů podle normy ČSN EN ISO 10705-2 [3] není vhodný pro pitné vody, šedé vody a některé povrchové vody, tedy tam, kde se očekává velmi nízká nebo nulová koncentrace kolifágů. U těchto typů vod bude ve většině případů nutné používat koncentrační metody uvedené v ČSN ISO 10705-3 [4], kterými dojde k převedení somatických kolifágů ze vzorku o větším objemu do objemu menšího. Metody jsou vybírány na základě objemu vzorku, obsahu částic nebo zákalu. Z prozatím získaných zkušeností s metodou flokulace hydroxidem hořečnatým a membránovou filtrací na elektronegativních filtrech lze říci, že druhá zmíněná metoda je schopna účinněji zkoncentrovat somatické kolifágy ze vzorku vody. Kromě toho, že je poměrně rychlá a prostorově méně náročná, bude pravděpodobně také provozními laboratořemi lépe proveditelná.
Poděkování
Tento výstup vznikl v rámci projektu Specifického vysokoškolského výzkumu – projekt č. A2_FTOP_2020_026.
