This article is available in Czech only. For translation or more information on this topic, please contact author.
Souhrn
Nanomateriály získaly velkou pozornost v různých oblastech díky svým unikátním vlastnostem. Jednou z možných aplikací nanovláken, díky jejich specifickému povrchu, je nosič biomasy, tedy imobilizace mikroorganismů následovaná tvorbou biofilmu. Protože vlastnosti nanovlákenného nosiče mají významný dopad na rychlost mikrobiální kolonizace a funkčnost biofilmu, variabilita parametrů při přípravě nanovláken (materiál, modifikace, struktura povrchu apod.) umožňuje vytvořit specifické prostředí pro dané bakterie.
Hlavním cílem této práce je zkoumání vlastností nanovláken připravených různými zvlákňovacími technologiemi a hodnocení jejich aplikace při biologickém čištění odpadních vod. Jako materiál byly pro výrobu nanovláken využity dva typy polymerů, polyuretan a polyvinylbutyral, které byly zvlákněny za obdobných podmínek. Pro přípravu nanovlákenných materiálů bylo použito pět zvlákňovacích technologií: zvlákňování střídavým proudem, zvlákňování stejnosměrným proudem z tyčky, z jehly a ze struny (technologie NanospiderTM) a elektro-odstředivé zvlákňování. Analýza struktur a morfologie nanovláken včetně drsnosti povrchu byla provedena pomocí skenovací elektronové mikroskopie (SEM) a pomocí konfokální mikroskopie, zatímco biologická rozložitelnost nanovláken byla stanovena normovaným respirometrickým testem (stanovení BSK). Na základě výsledků z těchto analýz byl zvolen nejvhodnější nanovlákenný materiál pro biologické aplikace – polyvinylbutyral připravený pomocí technologie NanospiderTM, který byl následně testován v biologickém laboratorním reaktoru jako nosič biomasy. Během provozu bioreaktoru byl sledován průběh nitrifikace, resp. růst nitrifikačních bakterií pomocí respirometrie a molekulárně-genetických metod (FISH a real-time qPCR). Výsledky analýz ukazují, že zvolený PVB nosič výrazně podporoval růst biomasy, kde bylo pomocí molekulárně genetických metod nalezeno značné zastoupení nitrifikačních bakterií. Navíc, chemismus reaktoru v průběhu experimentu potvrzoval vysokou účinnost nitrifikačního procesu.
Úvod
Materiály z nanovláken (netkané textilie, scaffoldy a jiné 3D struktury) byly již použity v mnoha komerčních a výzkumných oblastech – filtrace, biotechnologie, různé environmentální aplikace, farmaceutický průmysl, kosmetika, tkáňové inženýrství a medicína [1–3]. K přípravě nanovláken lze použít řadu dostupných technik, jako je separace fází, drawing, samoskladba, chemické depozice z plynné fáze, meltblown, elektrospinning [4] atd. Elektrostatické zvlákňování je v současnosti značně rozšířené a dává možnost vyrábět nanovlákna v průmyslovém měřítku [5]. S přípravou nanovlákenných materiálů a jejich budoucí aplikací jsou spojena tři základní témata: (1) možnost ekonomicky výhodné velkoobjemové výroby, (2) vhodné nastavení a reprodukovatelnost ve všech fázích výroby a (3) bezpečnostní a environmentální atributy.
Nanovlákna připravená pomocí elektrostatického zvlákňování mají vysoký poměr plochy povrchu k objemu, značnou pórovitost, dobré mechanické vlastnosti a velmi specifické povrchové vlastnosti [1]. Možnost zpracování široké škály polymerů poskytuje prostor pro manipulaci a kontrolu povrchové struktury nanomateriálů, průměrů vláken a pórovitosti [6]. Průměr vláken a další vlastnosti lze ovlivnit koncentrací polymeru, molekulovou hmotností nebo koncentrací či viskozitou roztoku, nastavením elektrického napětí, zvolenými technickými parametry zařízení (zvlákňovací tryska, průměr elektrody, vzdálenost elektrod apod.) a parametry okolního prostředí [7, 8].
Polyvinylbutyral (PVB) je netoxický polymer bez zápachu a šetrný k životnímu prostředí a je vhodnou organickou složkou pro výrobu organických/anorganických hybridních kompozitů. PVB je široce používán v mnoha aplikacích kvůli nízkým nákladům na výrobu, flexibilitě, dobré přilnavosti a kvůli jeho dlouhodobé stabilitě. Navíc vykazuje dobré mechanické a vynikající dielektrické vlastnosti a je odolný vůči vlhkosti (stabilita ve vodném prostředí) [9]. Polyuretan (PUR) má širokou škálu různých chemických modifikací, na kterých závisí jeho výsledné mechanické a fyzikálně-chemické vlastnosti. Lze připravit PUR biologicky stabilní a zároveň biokompatibilní. Tyto polymery byly vybrány pro jejich rozdílné strukturální vlastnosti, průmyslovou produkci (široké využití) a dobré mechanické vlastnosti.
Nejčastěji se charakterizace nanovlákenných materiálů zajišťuje pomocí skenovací elektronové mikroskopie (SEM). Jen málo prací však zkoumá vliv procesních parametrů na morfologii výsledné nanovlákenné sítě [7], s výjimkou hodnocení průměru vláken [5, 8, 10–12]. Za účelem zjištění specifických vlastností nanomateriálů je nezbytné pochopit ovlivnění distribuce a struktury nanovláken samotným zvlákňovacím procesem. Například integrita povrchu má značný vliv na adhezi buněk, jejich růst a proliferaci, zatímco vnitřní struktura nanovláken ovlivňuje uvolňování inkorporovaných biologicky aktivních látek a proliferaci buněk do vnitřní struktury materiálu [6]. Charakterizace nanovláken je v současnosti považována za jednu z nejzajímavějších oblastí výzkumu nanovláken. Z tohoto důvodu jsme provedli podrobnou analýzu připravených nanovláken pomocí obrazové analýzy snímků SEM s cílem posoudit základní strukturální vlastnosti nanovláken důležité pro biologické interakce.
Konkrétně pro biologické aplikace (např. nosiče biomasy) nanovlákenných struktur je nutné znát jejich detailní charakteristiku, aby bylo možné odhadnout chování bakterií (biofilm) na jejich povrchu, respektive v povrchové struktuře. Základními parametry jsou povrchový náboj, pórovitost, morfologie povrchu, která silně souvisí s buněčnou adhezí a další specifické fyzikálně-mechanické vlastnosti [13, 14]. Například u procesu nitrifikace a denitrifikace v odpadních vodách dochází k značnému ovlivňování aktivit mikroorganismů typem biomasy, ve které se bakterie nachází (aktivovaný kal/biofilm na nosičích), a tedy k ovlivňování účinnosti zmíněných procesů. Výhody použití těchto typů nosičů v oblasti čištění odpadních vod jsou popsány ve studii Sharma a kol. [15]. V současné době je použití nosičů biomasy jedna z možností, jak zvyšovat účinnosti stávajících ČOV bez nutnosti finančně náročných stavebních úprav objektů.
Materiály a metody
Použité polymery
V této studii byly použity dva typy polymerů – PVB a PUR. Desetiprocentní hm. roztok PVB (Mowitals B 60 H, Kuraray America Inc., USA; průměrná molekulová hmotnost 60 000 amu) byl připraven v etanolu (9: 1 Et-OH: PVB). Nejvhodnější polymerní roztok PUR (tj. nejvhodnější parametry pro elektrostatické zvlákňování, zejména pokud jde o viskozitu) byl vybrán z rozmezí koncentrací PUR v dimethylformamidu (18–35 % hm.). Nemůžeme poskytnout podrobnější informace o koncentracích použitých v tomto bodě, protože jsou předmětem průmyslové ochrany.
Použité zvlákňovací metody
Pro přípravu nanovláken bylo použito pět typů zvlákňovacích metod (elektrospinning) se stejnosměrným a střídavým zdrojem napětí (viz tabulky 1 a 2). Podstatou elektrospinningu je tvorba nanovláken z polymerního roztoku za přítomnosti elektrických sil. Metody se liší zdrojem napětí, typem elektrod a kolektorů, uspořádáním zařízení, produktivitou, strukturou připravených nanovláken a dalšími specifickými parametry.
Tabulka 1. Procesní parametry pro přípravu PVB nanovláken
Table 1. Process parameters for the preparation of PVB nanofibers

Tabulka 2. Procesní parametry pro přípravu PUR nanovláken
Table 2. Process parameters for the preparation of PUR nanofibers

Mikroskopická charakterizace nanovláken
Snímky SEM byly vyfoceny pomocí mikroskopu UHR FE-SEM Carl Zeiss ULTRA Plus (Carl Zeiss, Německo) při zvětšení 12–1 000 000× v režimu SE a při akceleračním napětí 0,02–30 kV. Vzorky nanovláken (bez podkladové vrstvy) byly pečlivě nařezány na čtverce o velikosti 5 × 5 mm a připevněny k terčům pomocí lepicí pásky. Na vzorky byla nanesena zlatá vrstva (přístroj Coorum Q150R ES, Quorum Technologies, UK), aby byla zajištěna dostatečná vodivost pro všechny vzorky.
Analýza obrazu byla provedena v programu Matlab [16] a zahrnovala šest základních kroků, které byly naprogramovány v rámci této práce. Konfokální mikroskopie byla provedena na vysoce výkonném 3D optickém mikroskopu S neox (Sensofar metrology, Španělsko) s objektivem EPI 20X v35, který umožňuje bezkontaktní optické 3D profilování. Neox používá senzor s vysokým rozlišením 1 360 × 1 024 pixelů (pozorovaná plocha 850,08 × 709,32 µm). Vzorky nanovláken (bez podkladu) byly nařezány na čtverce 10 × 10 mm a přilepeny k laboratornímu sklíčku pomocí lepicí pásky, čímž byla zajištěna stabilita vzorků pro vyhodnocení povrchu. Na vzorky byla nanesena zlatá vrstva pro snížení transparentnosti nanovláken.
Biodegradace nanovláken
Biologická rozložitelnost nanovláken byla stanovena pomocí respirometrie na základě měření biologické spotřeby kyslíku (BSK) v přítomnosti aerobních mikroorganismů ve vodném prostředí podle EN ISO 1485. Hodnota BSK byla měřena pomocí respirometru Micro-Oxymax (Columbus Instruments Int., USA). K testu byla použita destilovaná voda (vodivost 3,0 S·cm-1) a standardní testovací medium (podle normy). Bakteriální inokulum bylo připraveno odsazením aktivovaného kalu odebraného z čistírny odpadních vod (Liberec, Česká republika; vzorkované na konci nitrifikační nádrže). Hmotnost sušiny kalu byla 4,3 g·l-1 a hodnota KTJ (kolonie tvořící jednotky) byla stanovena na 100 000 KTJ·ml-1. Vzorky byly měřeny v duplikátu po dobu 28 dnů. Výsledné hodnoty biodegradace Dt pro každý vzorek byly vypočteny jako (BSK * 100)/TSK, kde TSK je teoretická spotřeba kyslíku v mg·g-1.
Laboratorní biologický reaktor
Model biologického reaktoru (obr. 1) tvoří otevřená silnostěnná skleněná nádoba (Ø 24 cm) o objemu 18 litrů. Na dně nádoby jsou po stranách instalovány provzdušňovací elementy napojené na dmychadlo (AirMac, DB40, 48 l·min-1), které zajišťuje homogenní provzdušňovaní systému. Před zahájením provozu byl bioreaktor inokulován aktivovaným kalem z nitrifikační nádrže komunální ČOV Liberec. Do reaktoru byla jako nátok přiváděna modelová odpadní voda obsahující NH4Cl jako zdroj dusíku a fosfátový pufr pro stabilizaci pH a jako zdroj fosforu (PO43-). Celkový objem vody v reaktoru byl 8 l (při maximálním naplnění). Kontinuální provoz byl zajišťován peristaltickými čerpadly (Watson Marlow Sci-Q323). Na dně nádoby byly v nerezových rámečcích umístěny testované nosiče biomasy o velikosti 55 × 55 mm. Celý systém nosičů byl nepřetržitě ponořen.
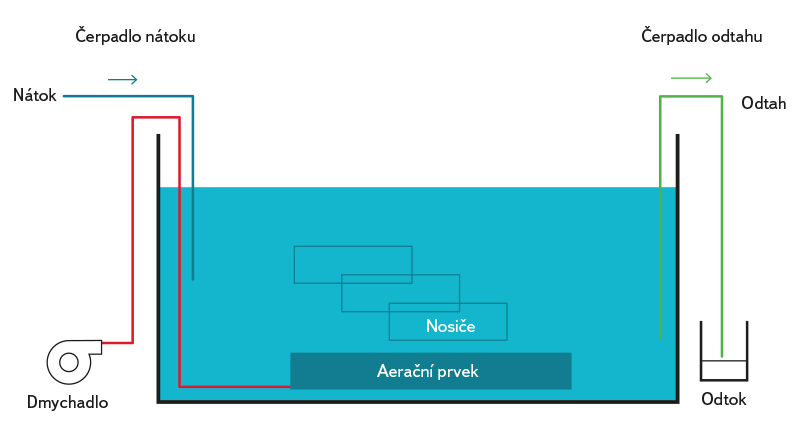
Obr. 1. Schéma prototypu biologického reaktoru pro testování nosičů biomasy
Fig. 1. Schema of a prototype biological reactor for testing biomass carriers
Biologický modul pracuje jako SBR (Sequencing Batch Reactor) ve dvou operačních cyklech během dne. První tři dny probíhalo v bioreaktoru cyklické opakování následujících procesů: nátok + aerace (10,5 h), nátok + sedimentace (0,5 h) a odtah odpadní vody na polovinu objemu reaktoru (0,5 h). Po odkalení bioreaktoru (po třech dnech od spuštění) byla aerace spuštěna nepřetržitě a k sedimentaci již nedocházelo. Dále byla udržována pouze biomasa přisedlá/narostlá na nosičích, tj. bez suspendovaného kalu. Teplota vody byla stabilně v rozmezí 19 až 22 °C a pH v neutrální oblasti, nanejvýš v mírně kyselené. Koncentrace jednotlivých sloučenin dusíku a fosforu a CHSK byly měřeny pomocí kyvetových testů (od společnosti Lange) na spektrofotometru HACH DR 6000 UV-VIS od společnosti Hach-Lange.
V průběhu experimentu byl vývoj nitrifikačních bakterií, tj. amoniak oxidujících (AOB) a dusitan oxidujících (NOB) bakterií, v biofilmu na nanovláknech pozorován pomocí real‑time kvantitativní polymerázové řetězové reakce (qPCR). Na konci experimentu byla navíc přítomnost AOB a NOB na nanovláknech analyzována pomocí metody fluorescenční in situ hybridizace (FISH) a aktivita nitrifikační mikroflóry byla sledována pomocí respirometrického měření.
Metody molekulárně-genetické
Pro detekci přítomnosti AOB a NOB v biofilmu na nanovláknech z bioreaktoru pomocí molekulárně-genetických metod, real-time qPCR a FISH, byla vytřepána biomasa ze čtverce nanovláken o velikosti 6 × 6 mm použitím ultrazvuku (15 min, 35 kHz, 20 °C). Z vytřepané biomasy byla pro účely real-time PCR provedena extrakce bakteriální DNA, zatímco pro FISH analýzu proběhla fixace a permeabilizace buněk.
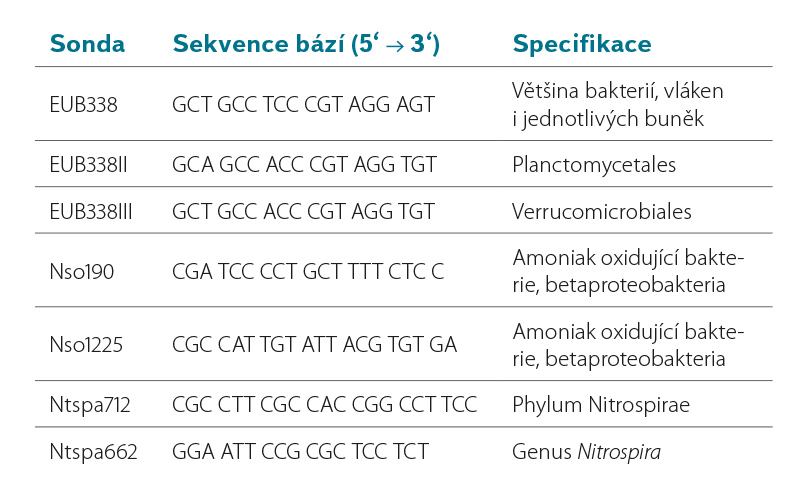
Extrakce DNA z biomasy byla provedena pomocí kitu specializovaného na vysoce inhibované vzorky, NucleoSpin Soil (Macherey-Nagel, Německo). Koncentrace DNA byla měřena pomocí fluorometru Qubit® 2.0. Z izolované DNA byla provedena real-time qPCR analýza na přístroji LightCycler® 480 (Roche). Jako fluorescenční zdroj bylo použito fluorogenní interkalační barvivo typu SYBR Green. Cílem qPCR analýzy bylo na jednotlivých nosičích detekovat jak celkové bakteriální oživení, tak přítomnost funkčních genů a klíčového mikrobiálního konsorcia podílejících se na obou krocích nitrifikace, oxidace amoniaku (AOB) a dusitanu (NOB). Informace k testovaným markerům pro real-time qPCR jsou uvedeny v tabulce 3.
Tabulka 3. Seznam testovaných markerů
Table 3. List of tested markers

Protokol metody FISH sestával ze čtyř základních kroků: (1) fixace a permeabilizace buněk, (2) hybridizace fluorescenčních sond specifických pro EUB, AOB a NOB, (3) vymytí nenavázaných sond a (4) mikroskopická analýza. Detekce označených buněk byla provedena pomocí fluorescenčního mikroskopu ZEISS Axio Imager.M2 s kamerou AxioCamICc1. Kvantifikace označených buněk na snímcích z fluorescenčního mikroskopu byla provedena pomocí programu Matlab (MathWorks). Vyhodnocení přítomnosti a množství specifických bakterií (AOB, NOB a EUB) bylo prováděno na základě poměru ploch buněk s červenou fluorescencí (AOB nebo NOB) k oblastem buněk se zelenou fluorescencí (EUB). Z každého vzorku bylo pořízeno cca 20 snímků. Použité FISH sondy jsou shrnuty v tabulce 4.
Tabulka 4. Seznam a popis použitých FISH sond
Table 4. List and description of used FISH probes
Metoda respirometrická
Systém respirometru Micro-Oxymax (Columbus Instruments) se v základu skládá z čerpadla vzorků, rozšiřovacího rozhraní a individuálních plynových čidel pro každý měřený plyn. Průtoky plynů mohou být zvoleny od 100 do 500 ml·min-1 a rozsahy senzorů jsou pro CO2 0–0,9 % a pro O2 15–21,5 %.
Pro respirometrické měření byl vzorek nanovlákenného nosiče z bioreaktoru (čtverec 55 × 55 mm) umístěn do láhve obsahující 200 ml BSM média, 20 mg·l-1 N-NH4+ a 10 ml fosfátového pufru. Připravené láhve byly následně umístěny na respirometr, kde byl po zadání parametrů měření celý systém utěsněn, a lahve se vzorky byly umístěny na třepačku, která zajišťovala promíchávání obsahu během měření. Vyhodnocení respirací probíhalo v programu Matlab (The Mathworks, Inc.).
Výsledky a diskuse
SEM a analýza obrazu
Vizualizace struktury nosičů pomocí SEM (obr. 2) a následná analýza obrazu se v této studii ukázaly jako klíčové pro pochopení interakcí mezi buňkami a nosičem. Analýza SEM snímků (obr. 3) přispěla k rozlišení základních rozdílů mezi testovanými nanovlákennými materiály a umožnila stanovit nejvhodnější polymer a metodu pro přípravu vhodného nosiče biomasy.
Obr. 2. SEM snímky nanovlákenných nosičů PUR (vlevo) a PVB (vpravo) z metod (a, A) AC elektrospinning, (b, B) tyčka (DC), (c, C) NanospiderTM (DC), (d, D) jehla (DC) a (e, E) elektro-odstředivé zvlákňování (DC); měřítko odpovídá 5 µm
Fig. 2. SEM images of nanofiber carriers PUR (left) and PVB (right) from methods (a, A) AC electrospinning, (b, B) rod (DC), (c, C) NanospiderTM (DC), (d, D) needle (DC) and (e, E) electro-forcespinning (DC); the scale corresponds to 5 µm
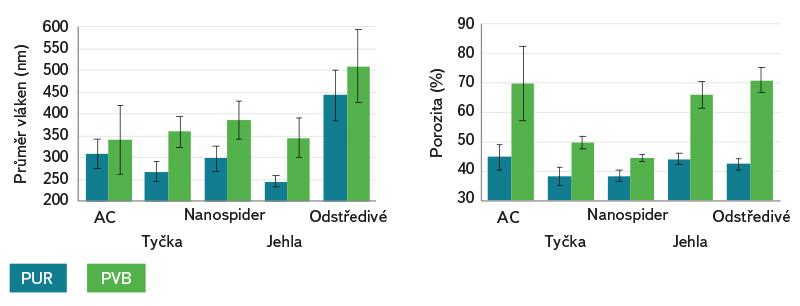
Obr. 3. Výsledky analýzy obrazu SEM: (a) průměr vláken (v nanometrech), (b) pórovitost vláken (v procentech); všechna data jsou zobrazena jako průměrné hodnoty se standardní odchylkou
Fig. 3. Results of SEM image analysis: (a) fiber diameter (nanometers), (b) fiber porosity (percent); all data are displayed as mean values with standard deviation
Nejmenší průměr měla u obou polymerů nanovlákna vyrobená metodou DC elektrospinning z jehly, což bylo pravděpodobně způsobeno horizontální konfigurací jehlové elektrody, která má navíc malý průměr. Polymer prochází úzkým prostorem na výstupu z elektrody (jehly), a proto je již v tomto bodě tvarován. Jakékoli snížení vnitřního průměru jehly zvyšuje povrchové napětí roztoku a má za následek menší kapičky, což způsobuje snížení rychlosti letícího nanovlákna a poskytuje delší časový úsek pro tažení, resp. tváření vlákna. Naopak nejsilnější nanovlákna byla získána z odstředivého elektrostatického zvlákňování s PVB polymerem, kde nedocházelo k tak výraznému tažení vláken jako v případě metod ostatních (kratší dráha letu vlákna). Jiné způsoby zvlákňování nevykazovaly znatelné změny průměrů nanovláken. PUR nanovlákna měla také tendenci být kompaktnější (tj. hustější uspořádání) a tvořila koherentnější vrstvu obsahující méně viditelné defekty, tj. mezery mezi vlákny byly rovnoměrnější.
Poréznost PUR polymeru dosáhla hodnot v rozmezí 38 až 45 %. Velikost pórů byla mírně větší při použití AC a odstředivého elektrostatického zvlákňování. PVB nanovlákenné struktury vykazovaly drsnější uspořádání povrchu a chaotičtější řazení jednotlivých vláken, což pravděpodobně souviselo s pórovitostí struktur. Nejnižší porozity a velikosti pórů pro PVB bylo dosaženo na Nanospideru, avšak výsledky porozit se globálně příliš neliší.
Vyhodnocení dále ukázalo, že typ zvoleného polymeru i použitá zvlákňovací technologie měly výrazný vliv na uspořádanost nanovlákenné struktury. Nejvyšší linearita vláken byla dosažena odstředivým elektrostatickým zvlákňováním s PVB polymerem, zatímco nejvyšší stupeň neuspořádanosti vykazovaly PUR nanovlákna připravená AC zvlákňováním.
Konfokální mikroskopie
Chování buněk na polymerních materiálech (např. adsorpce a proliferace) závisí do značné míry na povrchových vlastnostech materiálu, včetně smáčivosti, hydrofility/hydrofobity, chemickém složení, distribuci povrchového náboje, tuhosti a zejména drsnosti povrchu. Při studiu povrchu nanovlákenných struktur pomocí konfokální mikroskopie lze hodnotit jejich makro-geometrii (tvar, zavlnění povrchu), mikro-geometrii (drsnost povrchu) a nano-geometrii (drsnost jednotlivých vláken). Tato metoda je považována za užitečnou a nedestruktivní možnost charakterizace povrchu široké škály materiálů. Členitost povrchu PVB nanovláken je zobrazena na obr. 4.
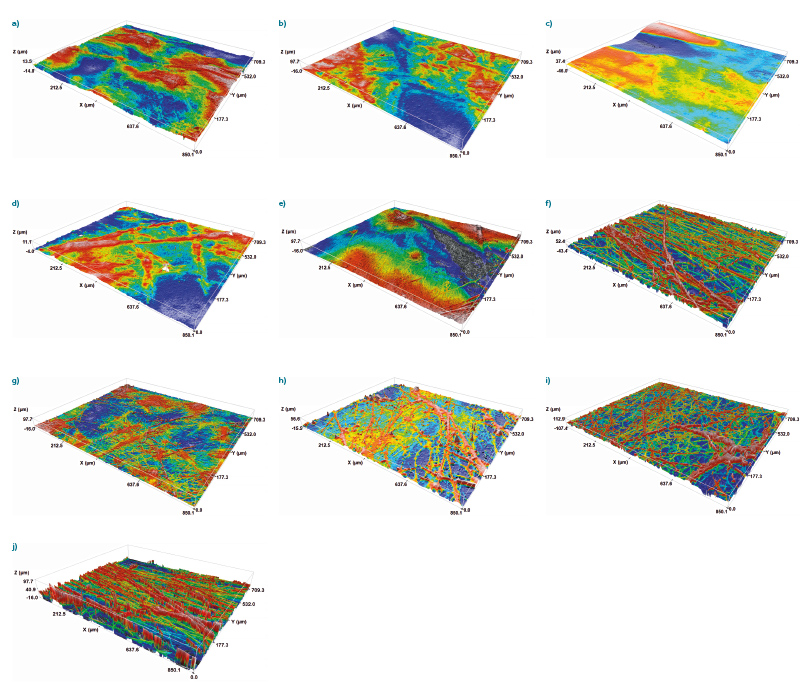
Obr. 4. Snímky z konfokální mikroskopie povrchu nanovlákenných nosičů PUR (a–e) a PVB (f–j) z metod (a, f) AC elektrospinning, (b, g) tyčka (DC), (c, h) NanospiderTM (DC), (d, i) jehla (DC) a (e, j) elektro-odstředivé zvlákňování (DC); horní vrstvy nanovláken jsou zobrazeny červeně, zatímco spodní vrstvy nanovláken jsou modré
Fig. 4. Confocal microscopy images of the surface of nanofiber carriers PUR (a–e) and PVB (f–j) from methods (a, f) AC electrospinning, (b, g) rod (DC), (c, h) NanospiderTM (DC), (d, i) needle (DC) and (e, j) electro-forcespinning (DC); the top layers of nanofibers are shown in red, while the bottom layers of nanofibers are blue
Hlavní rozdíl mezi nanovlákennými strukturami PUR a PVB z různých zvlákňovacích metod byl v drsnosti povrchu nanovláken (obr. 5), jak ukazuje konfokální mikroskopie. Ve většině případů měl PUR hladší povrch, což může být dáno jeho specifickými vlastnostmi (viskoelastický a vykazuje slabší intramolekulární síly). Naproti tomu PVB je amorfní termoplastický polymer, jehož nanovlákenná vrstva vykazovala drsnější povrch, tj. nanovlákna vyčnívala více na povrch a netvořila hladkou rovnoměrnou vrstvu. To bylo pravděpodobně způsobeno vyšší přítomností deformovaných nanovláken ve vrstvě PVB v kombinaci s jejich chaotickým uspořádáním. Nejedná se tedy pouze o plošnou nerovnoměrnost povrchu, ale o bodové výstupy („nano“ a „mikro“ drsnost povrchu), které jsou důležité právě pro adhezi mikroorganismů k substrátu [17]. Konfokální mikroskopie i analýza SEM ukázaly, že z DC metod mají vrstvy kompaktnější a jemnější povrchy než z metody AC a odstředivého elektrostatického zvlákňování.
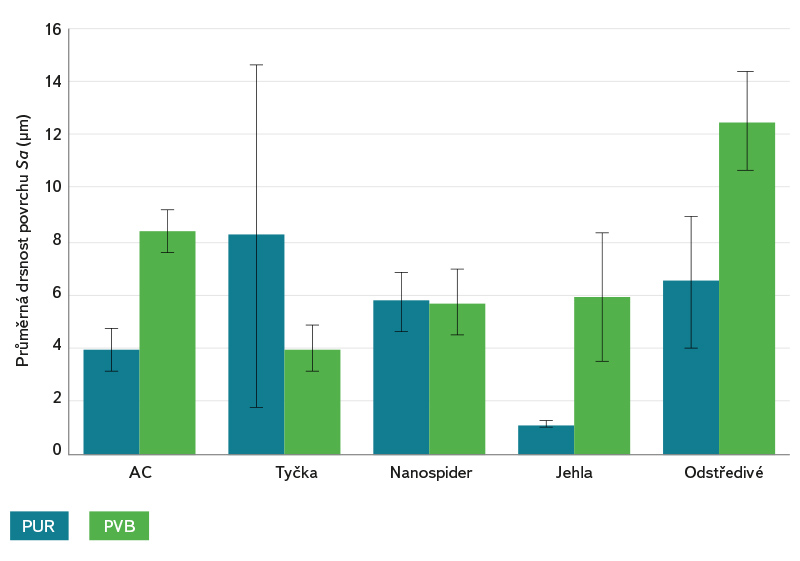
Obr. 5. Drsnost povrchu nanovláken (Sa) stanovená z analýzy snímků konfokální mikroskopie je zobrazena jako průměrná hodnota se standardní odchylkou
Fig. 5. Nanofiber surface roughness (Sa) determined from confocal microscopy image analysis is shown as the mean value with standard deviation
Biodegradace nanovlákenných nosičů
Rychlost degradace polymeru závisí převážně na jeho chemické struktuře, přítomnosti hydrolytických nestabilních vazeb, úrovni hydrofility/hydrofobity, krystalické nebo amorfní morfologii, poměru jednotlivých poměrů složek kopolymeru nebo jeho molekulové hmotnosti [10]. Očekává se, že buněčná proliferace i biologická rozložitelnost budou také záviset na uspořádání a geometrii nanovlákenných materiálů [18].
Biodegradace v této studii byla obecně velmi nízká pro oba polymery (ze všech metod). Byla prokázána stabilita obou polymerů v inokulovaném vodném prostředí a na základě výsledků lze jako jediný, avšak nepatrný, rozdíl zmínit zanedbatelně vyšší stabilitu PUR oproti PVB (v jednotkách tisícin procent). Biodegradace všech připravených nosičů tedy byla z makro-hlediska zanedbatelná, a tedy tyto nosiče se jeví jako vhodné pro používání ve vodném prostředí.
Biologické testování nosičů
Na základě výše zmíněné charakterizace nanovláken byla pro testování v bioreaktoru vybrána PVB nanovlákna připravená Nanospiderem jako nejvhodnější materiál z hlediska predikované proliferace buněk, náročnosti přípravy a ekonomických parametrů. Při výběru nejvhodnější zvlákňovací metody bylo nutné zohlednit možnost průmyslové produkce nanovláken Nanospiderem, což výrazně snižuje celkové náklady na výrobu. PVB je dnes velmi rozšířený polymer, jehož cena umožňuje přípravu levných, ale zároveň velmi kvalitních materiálů. Výrobní cena vrstvy PVB nanovláken vyrobené pomocí Nanospideru se pohybuje v řádech korun za 1 m2. Navíc, nanovlákna PVB připravená tímto typem zvlákňování mají vhodné strukturální vlastnosti a příprava zvlákňovacího roztoku je velmi snadná (prosté rozpuštění polymeru PVB v etanolu v daném poměru). Naopak v případě PUR je příprava zvlákňovacího roztoku podstatně složitější (nastavení zvlákňovacích parametrů, precizní namíchání polymerního roztoku a nízká zvláknitelnost metodou Nanospider) a cena jednotlivých složek je vyšší. Ekonomicky přijatelná varianta výroby nanovlákenných nosičů je také pomocí metody AC elektrospinning. Vrstvy z této metody jsou však více neuspořádané a jejich mechanická stabilita je podstatně nižší. U ostatních metod se cena příliš navyšuje díky nízké produktivitě a náročnější obsluze zařízení.
Porozita na úrovni 45 % u PVB je přijatelná pro osídlování bakteriemi a zároveň není příliš velká, aby se mikroorganismy dostávaly hluboko do vnitřní struktury, kde se značně snižuje kontakt s polutanty a dochází k nahromadění neaktivního biofilmu. Z hlediska povrchu je PVB oproti PUR jednoznačně výhodnější materiál pro výrobu nosiče biomasy, jelikož PUR je spíše hladší bez výraznějších bodových výstupů. Bioreaktor s vybranými PVB nosiči byl v provozu dva měsíce a byl sledován nárůst biofilmu na nosičích, resp. aktivita mikroorganismů.
Chemismus reaktoru
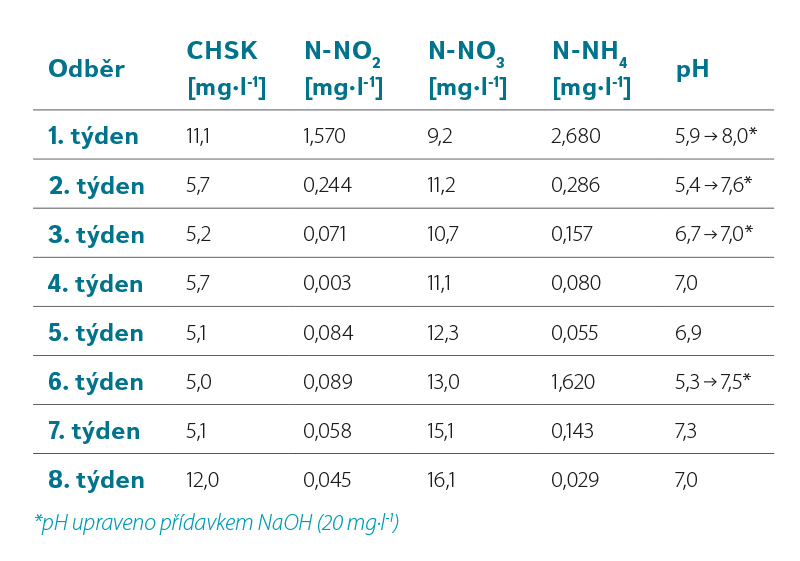
Průběžné fyzikálně-chemické testování reaktoru (tabulka 5) sloužilo ke sledování účinnosti nitrifikace.
Cílem chemické analýzy bylo sledování rozdílných koncentrací amoniakálního dusíku ve vstupní (modelové) vodě a v odtoku. Z poklesu koncentrace N-NH4+ iontů a z nárůstu N-NO3– iontů bylo možné sledovat míru oxidace amoniakálního dusíku na dusičnany. Sledováním koncentrace dusitanů byla ověřována kompletnost nitrifikace.
Koncentrace N-NH4+ v modelové vodě (nátok) kolísala mezi 9,5 a 15,0 mg·l-1. Koncentrace N-NH4+ v odtoku z reaktoru byla typicky menší než 0,5 mg·l-1, což ukazuje na vyšší než 95% účinnost oxidace amoniaku. Kompletní nitrifikace byla prokázána zanedbatelnou koncentrací N-NO2– iontů v reaktoru (< 0,1 mg·l-1).
Tabulka 5. Výsledky analýz chemismu bioreaktoru v týdenních intervalech
Table 5. Results of bioreactor chemistry analyzes at weekly intervals
Výsledky molekulární genetiky
Ve všech vzorcích PVB nanovláken odebraných z bioreaktoru bylo celkové bakteriální oživení na vysoké úrovni. V průběhu experimentu byl na všech nanovláknech detekován v nízkém množství funkční gen kódující klíčový enzym oxidace amoniaku (amoA) specifický pro AOB Nitrosomonas. Nápodobně bylo množství funkčních genů specifických pro NOB Nitrobacter (NxrB1, nxrA) na všech nanovláknech v průběhu experimentu velmi nízké až na mezi detekce. Markery specifické pro NOB Nitrospira (nxrB, NSR) byly, na rozdíl od NOB Nitrobacter, detekovány již ve velkém množství na všech nanovláknech od prvního odběru.
Nárůst celkové a testované specifické bakteriální biomasy na jednotlivých nanovláknech v průběhu experimentu byl vyjádřen pomocí relativní kvantifikace (obr. 6), jenž popisuje relativní změnu množství daného markeru vůči referenčnímu vzorku, kterým je v tomto případě vzorek z 1. odběru. Hodnota relativní kvantifikace referenčního vzorku je 1. Pokud je hodnota relativní kvantifikace vzorku 2, znamená to, že v tomto vzorku je dvakrát více cílové DNA než v referenčním vzorku. V případě specifického funkčního genu amoA (AOB Nitrosomonas) byl pozorován postupný nárůst v průběhu experimentu u všech nanovláken, stejně tak v případě NOB Nitrospira (NSR, nxrB). V průběhu experimentu se testovaná bakteriální biomasa výrazně neměnila, což indikuje, že v 1. odběru, tedy po 14 dnech od zanoření nanovláken, byl na povrchu nanovláken již stabilní biofilm. Množství testovaných markerů se výrazně nelišilo mezi jednotlivými kvadruplikáty.
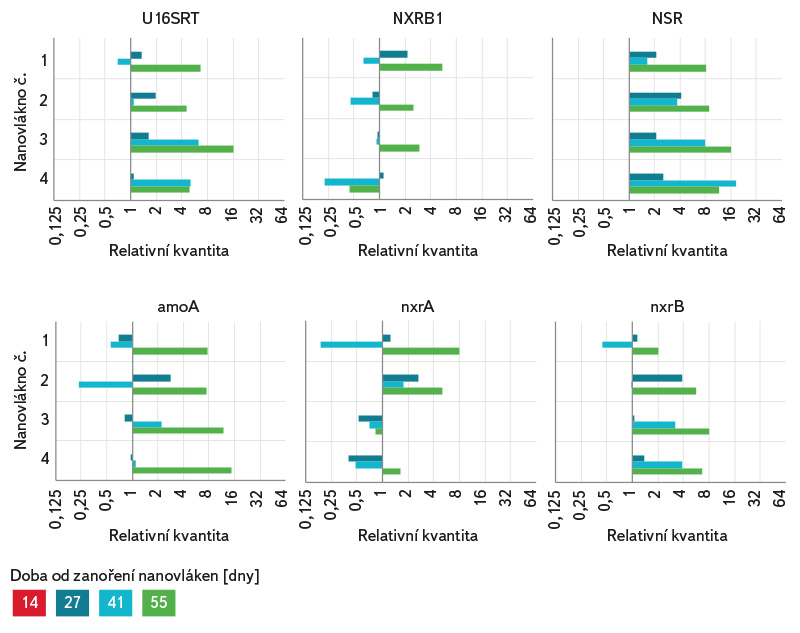
Obr. 6. Relativní kvantifikace celkové a specifické bakteriální biomasy na jednotlivých kvadruplikátech v průběhu experimentu vůči prvnímu odběru
Fig. 6. Relative quantification of total and specific bacterial biomass for individual quadruplicates during the experiment compared to the first sampling
Výsledky FISH analýzy posledního odběru potvrzují závěry z qPCR analýzy. Ze snímků (obr. 7) je patrné nízké celkové množství AOB ve vzorcích. Naopak značné zastoupení červené barvy (NOB) k zelené (EUB) ve snímcích je pro NOB, kdy se jednotlivé kvadruplikáty příliš neliší.
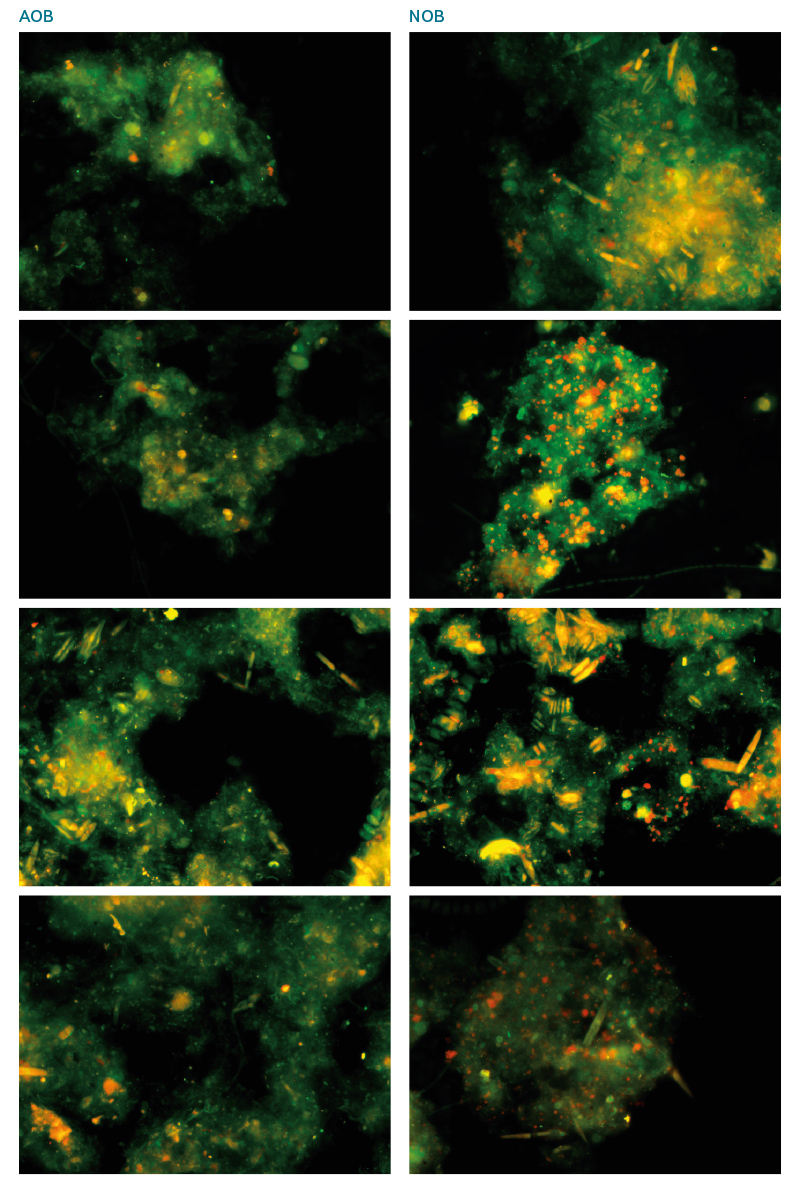
Obr. 7. Ukázka snímků z FISH analýzy posledního odběru, z každé sady snímků vybrán jeden od každého z kvadruplikátu pro AOB (vlevo) a NOB (vpravo)
Fig. 7. Images from the FISH analysis of the last sampling, one from each set of images selected from each of the quadruplicates for AOB (left) and NOB (right)
Celkově nižší množství AOB oproti NOB je běžný jev, který se vyskytuje na ČOV. Poměr AOB/NOB hraje zásadní roli v optimalizaci nitrifikačního procesu. V případě rychlejšího růstu AOB oproti NOB bude docházet k akumulaci dusitanů v systému, což povede k vytváření toxického prostředí. Naštěstí bylo prokázáno, že NOB mají dominantní zastoupení v nitrifikačním procesu a reálná situace neodpovídá teoretickým předpokladům, podle kterých by měly v systému převažovat AOB [19, 20].
Respirometrické testy
Respirometrie s nosiči PVB (po dvouměsíčním testování v biologickém reaktoru) byla provedena v kvadruplikátu s kontrolním vzorkem. Výsledky rychlosti spotřeby O2 (obr. 8) ukazovaly dobrou aktivitu nitrifikačních bakterií oproti blanku (pouze medium bez inokula). S ohledem na slabou vrstvu biofilmu na nosičích byla účinnost tohoto systému značná, což bylo potvrzeno stanovenou koncentrací N‑NH4+ ve vzorcích po ukončení respirometrie, která byla nižší než 1. Nanovlákenné nosiče nevykazovaly po ukončování experimentu viditelné poškození, tj. struktura se z makro-pohledu nezměnila oproti původnímu stavu.
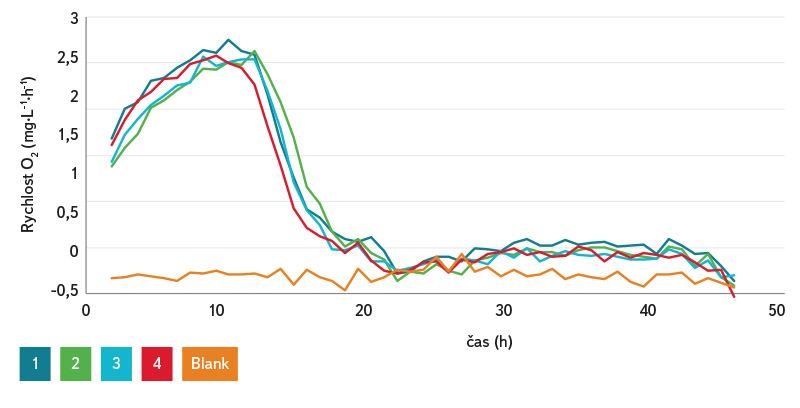
Obr. 8. Rychlost spotřeby kyslíku při závěrečném testování PVB nosičů na respirometru
Fig. 8. Oxygen consumption rate during the final testing of PVB carriers on the respirometer
Závěr
V rámci vývoje nanovlákenných struktur je velmi důležité detailně analyzovat a charakterizovat dané materiály. V případě testování těchto struktur v systémech čištění odpadních vod (nosiče biomasy) je důležitá i správná interpretace a hodnocení růstu biofilmu na testovaných nosičích. Biologické testy jsou založeny na odlišných principech a výsledky analýz různých metod jsou velmi často složitě porovnatelné. Metoda respirometrická hodnotí aktivitu specifické skupiny mikroorganismů v průběhu měření a dává celkový náhled o stavu sledovaných bakterií. Oproti tomu metody molekulárně genetické poskytují detailní náhled do biofilmu na úrovni DNA a sledují tedy konkrétní mikroorganismy (kvalitu i kvantitu), které se zde nacházejí. Analýza SEM snímků připravených materiálů se ukázala jako nezbytná pro charakterizaci nanovlákenné vrstvy. Pomocí této analýzy byly stanoveny parametry, tj. průměr vláken a porozita, pro určení nejvhodnějšího materiálu pro sledované biologické aplikace. Pomocí konfokální mikroskopie bylo možné detailně zobrazit drsnost povrchu, která je zásadní pro adhezi čistírenských bakterií, a vybrat tak vhodný materiál pro testování.
Z výše uvedeného vyplývá, že klíčovými prvky pro výběr vhodného materiálu k přípravě nosičů biomasy jsou výsledné struktury nanovláken, jejich povrch a stabilita ve vodném prostředí. Průměr vláken rozhoduje o povrchové ploše a mechanických vlastnostech, což jsou důležité parametry jak pro adhezi bakterií, tak pro životnost samotného nosiče. Charakteristiky povrchu jsou zásadní pro bakteriální adhezi a prostupnost bakterií a jejich extracelulární matrix těsně pod povrch (zabudování biofilmu do povrchu). S tímto souvisí i porozita nanovlákenného nosiče, která musí umožnit bakteriím vstup do vnitřní struktury nosiče, ale pouze do určité hloubky. V případě příliš velkých pórů dochází směrem dovnitř k zahušťování biofilmu a ve vzdálenějších vrstvách již nedochází ke kontaktu s polutanty ve vodě, což vede k úbytku bakteriální populace. V této fázi může docházet ke zvyšování hmotnosti nosiče, což je nežádoucí. Na základě vyjmenovaných parametrů a s ohledem na ekonomickou náročnost byl jako ideální nosič vybrán materiál z PVB nanovláken připravený metodou Nanospider. Průměr nanovláken (cca 400 nm) v tomto případě zajišťuje dobrou mechanickou stabilitu vrstvy a zároveň vlákna tvoří dostatečně jemnou vnitřní strukturu, což je pro bakterie výhodné. Porozita této vrstvy je v rozmezí, kdy bakterie a jejich produkty nepronikají příliš hluboko do struktury nosiče, ale zároveň v blízkosti povrchu jim vytváří vhodné prostředí. Povrch je dostatečně členitý a umožňuje výbornou bakteriální adhezi.
Biologické testování v bioreaktoru a následné hodnocení biofilmu ukázalo, že velmi specifický povrch PVB nanovláken připravených technologií Nanospider umožnuje velmi kvalitní adhezi čistírenských bakterií, které jsou v takovém biofilmu aktivní a jsou částečně chráněny před nepříznivými vlivy. Výsledky byly potvrzeny všemi hodnotícími metodami. Další vývoj je směřován do aplikovatelnosti těchto nosičů biomasy na poloprovozní testování, kde musí být brán ohled především na ekonomickou přínosnost.
Poděkování
Tato práce byla podpořena z projektu Studentské grantové soutěže (SGS-2019-3023) na Technické univerzitě v Liberci v roce 2020.

